《遗传资源的获取及公平公正地惠益分享名古屋议定书》(以下简称《名古屋议定书》)是为了补充1992年《生物多样性公约》,于2010年在名古屋制定通过的公约,以2015年在国际上生效为目标。达到这个目标曾经遇到了困难,但是最近欧盟理事会制定通过了实施名古屋议定书的欧盟规则(注1)(以下简称《欧盟规则》)。由于欧盟及其成员国出现了批准名古屋议定书的动向,因而今后缔约国将会迅速增加,很可能在今年内就生效(注2)。日本也在争取尽快批准,目前正在研究讨论国内措施(注3)。
名古屋议定书是一个很有特色的国际法,它要求遗传资源利用者所属国(利用国)检查利用者是否遵守遗传资源提供国的法律,如有违法,由利用国通过国内措施进行处理(例如加以惩罚)。一旦名古屋议定书生效,利用者将接受遗传资源提供国和利用国两方的检查。不但自己采集的遗传资源,而且经由第三者获取的遗传资源也不能逃避应履行的注意义务(due diligence)。因此,在国内措施严格的利用国,利用者的负担会显著加重。
遗传资源利用国在立法上需要解决的问题是如何一方面减轻利用者的负担,另一方面又履行国际公约。本文的目的是考察欧盟规则采用的实施办法,为今后讨论日本国内措施整理出有益的要点(注4)。
为理解欧盟规则所需的术语
“利用遗传资源”:名古屋议定书第2条(c)的定义是:“对遗传资源的遗传和生物化学组成进行研究和开发(包括应用生物技术)”,欧盟规则也使用这个定义。根据这个定义,例如进口和销售外国的水果不属于利用遗传资源;但如果从生物化学方面分析该水果,并研发药品就属于利用遗传资源;第三者把该药品作为其他产品的材料,不加任何改变地使用,也不属于利用遗传资源(注5)。
欧盟规则对于“与遗传资源相关的传统知识”及其“利用”没有特意进行定义(因为尚未形成国际协定),采取由当事者自行签订协议的立场(欧盟规则第3条第7款)(注6)。
“信息交换中心”:根据名古屋议定书第14条建立的获取与惠益分享(access and benefit sharing: ABS)的国际portal site,也称为clearing house,各国政府的对外联络机关名称、关于ABS的国内法及其他相关信息都在这里登记。
“国际公认的遵守证书”:根据名古屋议定书,遗传资源提供国向利用者提供下述证明文件:1)基于事先信息的同意(prior informed consent: PIC)决定;2)设定关于提供者与利用者之间利益分配的相互同意条件(mutually agreed terms: MAT)。把这个文件送交信息交换中心,作为“国际公认的遵守证书”(名古屋议定书第17条第2款)。
“收藏品(collection)登记”:根据欧盟规则,遗传资源或有关遗传资源的传统知识的收集物品称为“收藏品”,公布符合一定登记条件的物品收入“收藏品目录”(欧盟规则第5条)。登记条件有:(a)可以按例行手续向利用者提供遗传资源的样品;(b)可以出具合法获取遗传资源的证据,向利用者提供遗传资源;(c)可以记录并保存向利用者提供的遗传资源。
“注意义务”(due diligence):一般行为者在某个行为之前当然应予以注意的义务。欧盟规则规定,在利用者利用遗传资源时,有义务确认下述事项:1)是否依照提供国的法律获取了遗传资源;2)是否根据MAT进行利益分配(欧盟规则第4条第1款)。
“批准最佳实例(best practice)”:根据欧盟规则,利用者团体可以向欧洲委员会申请该团体制定并管理的自主遵守ABS法律措施属于欧盟规则所说的最佳实例(注7)(欧盟规则第8条)。如果欧洲委员会认为,只要利用者有效地实施该实例,就能够遵守欧盟规则规定的义务(即注意义务、在宣布已予以注意的同时提出证据的义务),就可以批准。名古屋议定书缔约国会议也可以采用最佳实例(名古屋议定书第20条)。这两种最佳实例都登记在欧盟目录中,并公布于互联网上。
第一个特点:登记收藏品与减轻注意义务
欧盟规则为了履行国际公约和减轻利用者负担的平衡,建立了事先登记可信赖的收藏品制度,这个制度的基本机制是,当利用者从已登记的收藏品中获取遗传资源时,视为已经履行了注意义务。
如果利用者从已登记收藏品之外的渠道获取遗传资源时,需要履行注意义务,这时只要有“国际公认的遵守证书”即可,以此减轻了利用者的负担(参见下图)。另外,虽然下图中没有标注,但部分粮食和农业植物的遗传资源也适用于“视为规定”(注8)。
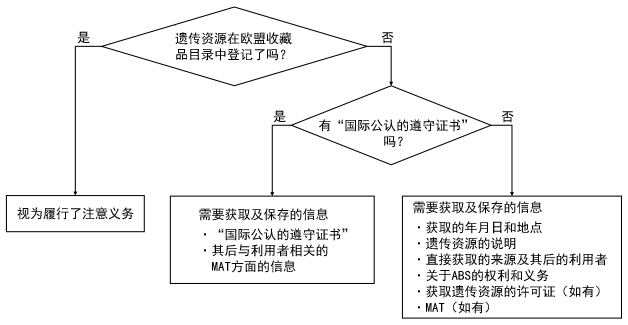
简要地说,利用者实际上负担的注意义务是通过欧盟收藏品目录之外的渠道获取的遗传资源,而且没有“国际公认的遵守证书”时才发生的。这时利用者获取和保存,并必须转让给后来的利用者的信息,是上图右下方列举的信息。如果连这些信息也没有,引起违法的嫌疑时,就必须停止利用(欧盟规则第45条)。
第二个特点:批准最佳实例与监测合理化
根据欧盟规则,监测基本上依靠自主申报。也就是说,领取研究资金的利用者可以在领取资金时宣布履行注意义务。另外,所有利用者都可以在产品最终研发阶段之前申报履行了注意义务,同时提供证据(欧盟规则第7条)。
当然,并不是完全依靠利用者自主申报,当局也适时进行检查。不过这种检查在下述两个方面实施了合理化。
一个是对于实施最佳实例的利用者,检查时考虑欧盟已经批准了他的最佳实例(欧盟规则第9条第1款)。另一个是发现违法嫌疑时进行检查。具体来说,(a)按照根据“风险评估(riskbase approach)”(注9)制定的计划(定期修改);(b)当局掌握了有关利用者违法的信息(包括第三者或提供国提供的信息)时进行检查(欧盟规则第9条第3款)。
检查的结果,如果发现利用者在遵纪守法方面有问题时,将根据利用者所属欧盟成员国的法律进行处罚,但需要关注的是,该国当局不能单方面采取措施,需要事先通知利用者,给他改正的机会(欧盟规则第9条第6款)。
其他关注点
第一,欧盟规则规定的适用范围是:“国家行使主权的遗传资源及有关遗传资源的传统知识,适用于名古屋议定书在欧盟生效日之后获取的遗传资源”。条文后半句限定了适用范围,“不追溯适用”的宗旨是妥当的。不过,前半句“国家行使主权……”,不包括国家违反CBD(生物多样性公约)行使主权,因此应限定于“国家依照CBD行使主权……”。此外还应探讨把“国家”限定于“名古屋议定书缔约国”。
第二,关于“遗传资源”的定义,欧盟规则的最初方案曾规定“派生物”也包括在遗传资源内,但是最终删除了“派生物”,把名古屋议定书采用的《生物多样性公约》第2条的定义也适用于欧盟规则。这一修改过程应成为日本的参考。
第三,对于在产业界的习惯或默认下形成的ABS(获取与惠益分享)遗传资源(例如医药用植物),欧盟规则没有明文规定,对此应做出规定,这种情况可视为利用者实际上履行了守法义务。
第四,欧盟规则第4条第8款规定了病原体利用者的具体注意义务和违反义务时对专利等的限制,但不一定是名古屋议定书的必须事项。这个规定可能是欧洲地区内部政治妥协的产物,在法律条文上也存在混乱(注10),日本没必要追随,应探讨其他方式(例如委托世界卫生组织(WHO)来决定)。
第五,关于履行注意义务的申报期限,欧盟规则规定应由欧洲委员会另行制定法令来确定为“产品最终研发阶段”(欧盟规则第7条第6款)。另外,申报义务的规定设置了1年的缓期适用。日本没必要一次全部实施,一部分可以根据情况以后再实施,应把分阶段的方式也纳入视野。
对日本政府及利用者的希望
日本政府(环境省)作为名古屋议定书的主办者希望尽快批准议定书是可以理解的,但是名古屋议定书是遗传资源的利用国和提供国政治妥协的产物,如何运用会对利用国的生物技术研发产生很大影响(至少难以预测)。因此依我之见,在批准前探讨国内措施时,对国际上的承诺应从最小必要限度开始,采取一边评估其效果和影响,一边分阶段推进的方式。
另外,一般财团法人生物产业协会(JBA)从名古屋议定书通过以前就制作了《获取遗传资源手册》(注11)这样的最佳实例,始终致力于普及(注12)。政府不应只急于国内措施立法化,而应一边宣传国内利用团体自发有效的活动,一边通过向全世界推广名古屋议定书的合理而具有建设性的实施模式,来开拓主办国履行责任之路。
与此同时,日本的利用者也需要转变意识和改革体制。遗传资源是人类共同财产,谁都可以免费自由利用的时代已经结束。在获取遗传资源之前,需要认真地调查提供国的国内法,依法采取行动已经成为国际规则。尤其是大学和国家研究机构等,应参考前述JBA《手册》等,尽快完善国际通用的最佳实例。


