異色の国際法
遺伝資源へのアクセスとその利用から生じる利益の公正かつ衡平な配分に関する名古屋議定書(以下「名古屋議定書」)は、1992年の生物多様性条約を補完することを目的として2010年に名古屋で採択された条約で、2015年までの発効が国際目標とされている。その目標の達成が危ぶまれていたが、このほどEU理事会が名古屋議定書を実施するためのEU規則(注1)(以下「EU規則」)を採択し、EUとその加盟国が批准に向けて動き出したので、今後批准国数が一気に増加し、年内にも発効する可能性が高まってきた(注2)。日本も早期の批准を目指し、現在、国内措置のあり方についての検討を進めているところである(注3)。
名古屋議定書は、遺伝資源の提供国の法令を利用者が遵守しているかどうかを利用者の国(利用国)がチェックし、違反があれば利用国の国内措置で対処する(たとえば罰則を課す)ことを国際約束とする異色の国際法である。これが発効すると、利用者は提供国と利用国の双方からチェックを受ける。遺伝資源をみずから採取する場合はもちろん、第三者を経由して取得する場合もそれなりの注意義務をまぬがれない。このため、利用国の国内措置によっては利用者の負担が著しく大きくなる。
そこで、利用国としての立法上の課題は、利用者の負担を下げながら、国際約束を果たすにはどうすればよいかである。本稿は、EU規則が採用した実施方法を概観し、今後の日本の国内措置のあり方についての検討にとって有益と思われる点を整理することを目的とする(注4)。
EU規則を理解するために必要な用語
「遺伝資源の利用」: 名古屋議定書2条(c)では「遺伝資源の遺伝的又は生化学的な構成に関する研究・開発を行うこと(バイオテクノロジーを用いて行うものを含む。)をいう」と定義されている。EU規則もこの定義を準用している。この定義によれば、たとえば、外国のフルーツを輸入・販売することは利用にあたらない。そのフルーツを生化学的に分析して薬品を開発することは利用にあたる。その薬品を他の製品の材料としてそのまま使用する第三者の行為は利用にあたらない(注5)。
なお、EU規則は、「遺伝資源に関連する伝統的知識」およびその「利用」については特段の定義を定めず(まだ国際合意が形成されていないため)、当事者の契約に委ねるというスタンスをとっている(EU規則3条7)(注6)。
「情報交換センター」: 名古屋議定書14条に基づいて構築されるアクセスと利益配分(access and benefit sharing: ABS)に関する国際ポータルサイト。クリアリングハウスともいう。各国の窓口官庁の名称、ABSに関する国内法令、その他の関連情報がアップされる。
「国際的に認められた遵守の証明書」: 名古屋議定書上、提供国は利用者に対し、1)事前の情報に基づく同意(prior informed consent: PIC)を与えるとの決定および2)提供者と利用者の間の利益配分に関する相互に合意する条件(mutually agreed terms: MAT)の設定を証明する文書を交付する。この文書が情報交換センターに届けられることによって「国際的に認められた遵守の証明書」となる(名古屋議定書17条2)。
「コレクションの登録」: EU規則上、遺伝資源または遺伝資源に関連する伝統的知識の集積物を「コレクション」といい、一定の登録要件をクリアしたものを公示することを「コレクションの登録」という(EU規則5条)。登録要件は、(a) 定型の手続で遺伝資源のサンプルを利用者に供給できること、(b) 適法に取得した遺伝資源であることの証拠を付して利用者に提供できること、(c) 利用者への提供を記録し保存することができることなどである。
「デューデリジェンス」: 一般には行為者がある行為の前に当然払うべきとされる注意義務。EU規則では、利用者が遺伝資源の利用に際し、1)提供国の法令上適法にアクセスされたものであるか、2)MATに基づく利益配分が行われるかを確認する義務をさす(EU規則4条1)。
「ベストプラクティスの承認」: EU規則上、利用者の団体は、その団体が作成・管理している自主的ABS法令遵守措置がEU規則にいうベストプラクティス(注7)にあたることの承認を求める申請を欧州委員会に行うことができる(EU規則8条)。欧州委員会は、その措置が利用者によって効果的に実践されれば利用者がEU規則上の義務(すなわち、デューデリジェンスを行う義務、それを行ったことを宣言し同時にその証拠を提出する義務)を遵守することが可能になると判断したとき、それを承認する。名古屋議定書の締約国会議もベストプラクティスを採択することができる(名古屋議定書20条)。これら2種のベストプラクティスは、EU登録簿に掲載され、インターネットで公開される。
第1の特徴: コレクションの登録とデューデリジェンスの軽減
EU規則は、国際約束の履行と利用者の負担軽減のバランスのために、信頼できるコレクションを事前に登録する制度を創設し、利用者が登録されているコレクションから遺伝資源を取得する場合は、デューデリジェンスを行ったものとみなすという仕組みを基本としている。
利用者が登録コレクション以外のルートから遺伝資源を取得した場合は、デューデリジェンスを行うことが必要になるが、この場合も「国際的に認められた遵守の証明書」があればそれで足りるとすることによって利用者の負担を軽減している(下図参照)。なお、図には示されていないが、食料・農業用の植物遺伝資源の一部についても「みなし規定」が適用される(注8)。
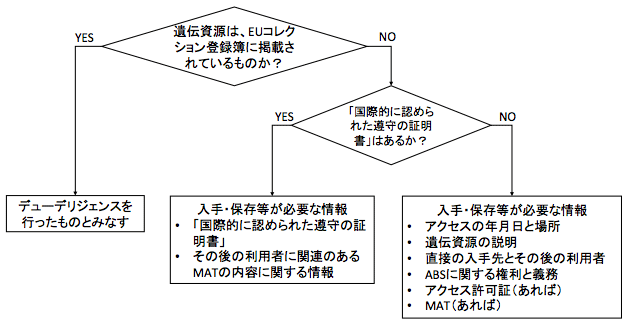
要するに、利用者に実質的なデューデリジェンスの負担が生じるのは、EUコレクション登録簿以外の経路で取得した遺伝資源であって、「国際的に認められた遵守の証明書」がない場合である。この場合、利用者が入手・保存し、その後の利用者に移転しなければならない情報は、図の右下に掲げる情報である。これらの情報もなく、適法性に疑念が残されているときは、利用を中止しなければならない(EU規則4条5)。
第2の特徴: ベストプラクティスの承認とモニタリングの合理化
EU規則上、モニタリングは、基本的に自主申告ベースである。すなわち、研究資金を受領する利用者は、たとえば受領の際にデューデリジェンスを行うことを宣言する。また全ての利用者は、デューデリジェンスを行ったことを製品の最終開発段階までに申告し、同時に証拠を提出する(EU規則7条)。
もちろん、全てが利用者まかせになっているのではなく、当局は、これを適宜チェックする。しかし、そのチェックは、次の2つの点で合理化されている。
1つは、EUによって承認されているベストプラクティスを実施する利用者については、そのことを考慮して合理的なチェックを行うという点である(EU規則9条1)。もう1つは、不遵守の疑念があるときチェックするという点である。具体的には、(a) 「リスクベースのアプローチ」(注9)に基づいて作成したプラン(定期的に見直される)に従って、(b) 利用者の不遵守に関する関連のある情報(第三者又は提供国から提供された情報を含む)を当局が所有するに至ったとき、チェックが行われる(EU規則9条3)。
チェックの結果、利用者の遵守状況に欠陥が発見された場合、利用者の属するEU加盟国の法令により罰則が課せられることになるが、当局は一方的措置をとることはできず、利用者に事前の通知が行われ、是正の機会が与えられる(EU規則9条6)ことにも注目しておく必要がある。
その他の留意点
第1に、適用範囲に関し、EU規則は、「国家が主権を行使する遺伝資源および遺伝資源に関する伝統的知識であって、名古屋議定書がEUについて発効する日の後にアクセスされるものに適用する」としている。後半の「遡及適用なし」の旨の限定は妥当である。ただし、前半の「国家が主権を行使する…」は、国家がCBDに反して主権を行使する場合を除くために「国家がCBDに従って主権を行使する…」と限定するのが望ましい。また「国家」を「名古屋議定書の締約国である国」と限定することも検討しておく必要がある。
第2に、「遺伝資源」の定義に関し、当初のEU規則案では、「派生物」も遺伝資源に含まれるとされていたが、最終的には「派生物」の部分が削除され、名古屋議定書が準用する生物多様性条約2条のとおりの定義をEU規則も準用することになった。この経緯は、日本も参酌すべきである。
第3に、業界の慣習や黙示の合意によってABSが行われていると考えられる遺伝資源(たとえば、薬用植物)について、EU規則は明文の規定を設けていないが、このようなケースでは事実上利用者の遵守義務が果たされているとみなす旨の規定を設けるべきである。
第4に、EU規則4条8は、病原体の利用者に関し、具体的なデューデリジェンスの規定と違反の場合の特許権等の制限について定めているが、名古屋議定書上必須のこととは思われない。これはたぶん欧州域内の政治的妥協の産物であろう。法文的にも混乱がある(注10)。日本としてこれを追う必要はなく、別のアプローチ(たとえば、世界保健機関(WHO)の取り決めに委ねること)を探るべきである。
第5に、デューデリジェンスを行った旨の申告義務の履行期限に関し、EU規則は、欧州委員会が「製品の最終開発段階」を別途の法令で特定すべきことを定めている(EU規則7条6)。またその申告義務の規定の適用には1年間の猶予期間が設けられている。日本としても全てのことを一度に実施する必要はなく、一部は施行の状況を見ながら後で実施するという段階的アプローチをとることも視野に入れるべきである。
日本の政府および利用者に望むこと
政府(環境省)が名古屋議定書のホスト国としてその批准を急ぐ事情は理解できるものの、名古屋議定書は、利用国と提供国の政治的妥協の産物であって、運用次第では利用国のバイオテクノロジーの研究・開発に与える影響が大きい(少なくとも不透明である)ことから、その批准のための国内措置を検討するにあたっては、国際約束上実施が必要な最小限のことからスタートして、その効果と影響を評価しながら、段階的に進めていくというアプローチを採用すべきではないかというのが私見である。
また一般財団法人バイオインダストリー協会(JBA)は、名古屋議定書が採択される以前から、「遺伝資源へのアクセス手引」(注11)のようなベストプラクティスを作成し普及に努めてきたという事実がある(注12)。政府は、単に国内措置の立法化を急ぐだけではなく、こうした国内利用者団体の自発的で効果的な活動をアピールしつつ、名古屋議定書の合理的で建設的な実施モデルを世界に広めることによってホスト国として責任を果たすという道もあるはずであると考える。
同時に、日本の利用者にも意識の転換とシステムの改革が必要である。遺伝資源が人類共有の財産であって、だれもがタダで自由に使える時代はとうに終わっている。遺伝資源については、アクセスの前に提供国の国内法令を丹念に調べ、それに沿った行動をとることが世界のルールになっている。特に大学・公的研究機関等においては、前述のJBAの「手引」などを参考にして、国際的にも通用するベストプラクティスの整備を早く進めることが望まれる。


